




浙江大学医学院基础医学系陈伟教授课题组。
杭州网讯 近日,浙江大学医学院基础医学系陈伟教授课题组联合中科院生物物理研究所娄继忠团队在国际知名期刊《分子细胞》上发表了最新研究成果,揭示了生物力在免疫T细胞识别肿瘤细胞过程中的重要作用。这项研究为未来寻找肿瘤新抗原以及基于新抗原的T细胞免疫治疗提供了基础理论和技术支持。
陈伟教授介绍说,T细胞识别肿瘤细胞,靠的是识别肿瘤细胞表面由基因突变所产生的新抗原。如何迅速、准确地识别肿瘤细胞表面抗原,是未来临床给予T细胞的免疫治疗关键之一。
识别“自我”与“非我”
准确快速找到并清除受病原感染的细胞或者基因突变的肿瘤细胞是维护生命体健康的重要保障,人体免疫系统中的CD8+T淋巴细胞(T细胞)在此过程中的发挥着至关重要的作用。
T细胞主要通过其表面受体TCR特异性识别靶细胞表面MHC-I分子呈递的“非我”或肿瘤新生抗原多肽(激动型),快速触发T细胞杀伤靶细胞的免疫功能。然而,人体内抗原种类繁多(>1018),而且“非我”抗原和“自我”抗原的差别极小(往往仅相差几个氨基酸残基)。
TCR如何迅速、精准地在浩如烟海的“自我”抗原中找到“非我”抗原是免疫学领域中最核心的问题之一,也是未来临床基于T细胞的免疫治疗(特别是TCR-T)的关键之一。
T细胞用生物力“钓”出肿瘤细胞
T细胞没有眼睛,那么它是如何识别“自我”与“非我”细胞的呢?陈伟教授曾于2014年在《细胞》(Cell)杂志上发表文章指出:TCR与激动型的抗原分子之间会产生特异性相互作用,且生物力可以增强其相互作用,从而放大“自我”与“非我”抗原之间的差别。
在本研究中,陈伟课题组进一步深入挖掘出了这个过程中的分子机制。他们发现,T细胞通过TCR分子与“非我”抗原相互作用后,生物力促使“非我”抗原的构象发生变化并与TCR形成“逆锁键”,TCR与非我抗原“粘贴”更加紧密且相互作用增强;同时,对于“自我”抗原,不发生上述构象变化,由此生物力可以迅速将其与TCR分子分开并削弱它们之间的相互作用(图1)。
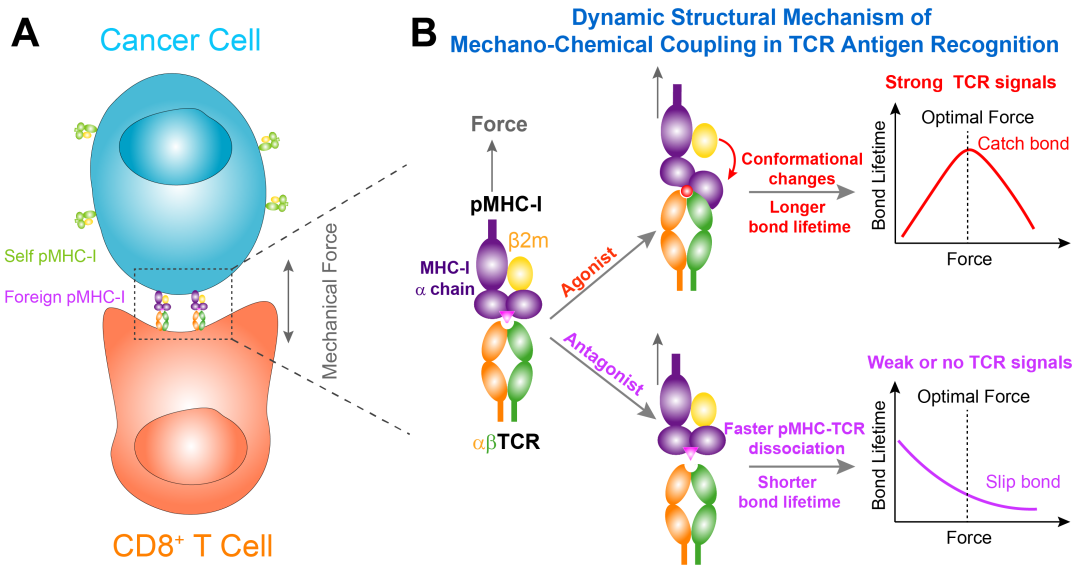
图1.(A)CD8+T细胞识别肿瘤表面的“非我”抗原。(B)TCR识别抗原的力学/化学耦联调控的分子机制。“非我”抗原(激动型)能够在生物力的诱导下, 发生构象变化,产生“逆锁键”(Catchbond), 增强其与TCR的结合时间;而“自我”抗原,生物力无法产生其构象变化, 只能产生“滑移键”(slip bond)。
这个生物力,就好像钓鱼时给鱼竿的一个拉力——一拉鱼竿,鱼与鱼钩更加吃紧(图2)。实验发现:不加力的情况下,“自我”与“非我”抗原与TCR的结合时间差不多;但是在加力的情况下,“非我”抗原与TCR的结合时间要长出十几倍。因此,生物力通过引发pMHC-I的构象变化,多部级联放大“自我”和“非我”抗原的差别,帮助TCR实现精准的“非我”抗原识别。

图2. “渔翁钓鱼”来比拟TCR利用生物力与“非我”抗原产生逆锁键,从而成功识别“非我”抗原。
研究结果不仅为T细胞精确识别不同抗原提供了重要的理论依据,同时对新生抗原的精确预测、新兴免疫治疗药物的开发(特别是基于新抗原的TCR-T细胞免疫治疗的研发)以及优化疾病临床免疫治疗方案提供了关键的基础理论和技术支持。
“这也是本项研究的精彩之处,通过生物力,肿瘤细胞和正常细胞在生物学上的差异被放大。”陈伟说,“因此未来如何能够通过这一规律,找到特异性识别肿瘤的T细胞并加以扩增,使其能够更有效的杀伤肿瘤细胞,是未来肿瘤免疫治疗(特别是实体瘤)的临床研究的重要方向之一。”
“部分晚期肿瘤病人的PD-1的免疫治疗效果不理想,其中一个原因有可能是T细胞激活的第一信号,抗原识别出了问题。”基于这个新机制,课题组还对临床PD-1的免疫治疗部分病人无效的潜在原因提出了新的观点:肿瘤病人的HLA一类分子的基因突变或者基因类型可能影响pMHC在生物力情况下的构象变化,削弱了TCR的抗原识别, 从而影响了PD-1等免疫治疗中T细胞的有效激活。
医工信交叉中不可小视的生物力
确实,在传统生物学研究中,生物力常常被忽视。“但是,细胞在生命活动中会将生物力施加到蛋白分子上,这时参与到细胞相互作用及信号传导中的力却不能简单忽略。”陈伟说。这也可以回答传统蛋白结构研究中,科研人员总结出发现“自我”与“非我”结构上的差别规律随着新的TCR及新抗原结构的发现,原有的区分规律不断失效;而生物力所导致的抗原呈递分子的构象变化很好地放大了“非我”和“自我”抗原分子的差别,揭示了更本质的TCR抗原识别的内在规律。
细胞内生物力是否真实存在呢?血流的剪切力,爬行中细胞骨架产生的拉力,细胞与细胞之间的粘附力等都可以作用在细胞及相关蛋白分子上。然而,就像我们身处重力环境下的万有引力,直到牛顿被苹果砸中人们才逐渐“看到”这个力的存在。
这项研究中,科研人员搭建了单分子检测仪器,通过单细胞水平的单分子生物膜力学探针,定量检测了一个T细胞受体和一个抗原分子之间生物力作用下的结合的时间,并测得细胞在寻找抗原的最佳力值和结合时间。另外,课题组通过高性能计算的分子动力学模拟计算出了TCR和抗原呈递分子的力致动态构象变化规律,同时结合生物化学和生物物理的方法,利用单分子磁镊技术直接观测到抗原呈递分子13纳米左右的力致构象变化。
“观测蛋白构象变化通常利用结晶、电镜、荧光显微镜成像等准静态的方法,但要达到纳米级的直接动态观测,特别是生物力作用下的蛋白质构象变化,上述方法比较难,而单分子力学操控技术则是一个更直接且更有效的方法,这也是去年诺贝尔物理学奖‘光镊’技术的重要应用之一。”陈伟介绍说。
“学科交叉研究其实很不容易。”陈伟2014年回国就开始了这项研究,结合生物、物理、化学、工程、计算机等领域团队,展开医工信交叉的研究。“我虽然在医学院工作,但本硕都是电气工程学院毕业,希望未来能够有更多的老师和同学进入到交叉合作的研究中。”陈伟笑着说,同时他对学校大力推进医工信交叉研究特别支持。
这项研究受到国家科技部蛋白质重大研究计划项目、国家自然科学基金委、浙江大学等项目经费的大力支持,特别感谢基础医学院、医学院附属第二医院、机械工程学院的大力支持;同时该研究也受到了感染性疾病协同诊治创新中心、生物医学工程与仪器学院、现代光学国家重点实验室等支持。
附:
论文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)31072-4
陈伟教授个人主页:https://person.zju.edu.cn/jackweichen

